Jag är säker på att de flesta av er har hört talas om det ”bra” och det ”dåliga” kolesterolet och ofta undrat vilket som är vilket när man ser på sina blodprovresultat. Jag hoppas att det inte längre kommer finnas något tvivel efter att ha läst denna avhandling (eller bara detta kapitel). Låt oss börja från början. Vår mat innehåller mycket fett, vilka även kallas lipider. Fett är inte lösligt i vattenbaserade miljöer, såsom blod, och måste därför transporteras i blodomloppet med hjälp av specialiserade proteiner, som ApoA-I proteinet. Lipid-proteinkomplexen, som till exempel kan ApoA-I som binder lipider till sig, kallas lipoproteiner. Det finns en mängd olika lipoproteiner som säkerställer att lipider transporteras till celler där de används för energi, till fettvävnad där de kan förvaras eller till levern där lipiderna bryts ned och tas bort från kroppen. När för mycket fett konsumeras kan den våra kroppar inte ta hand om det ordentligt vilket leder till ansamling av lipider i celler i olika organ, inklusive i blodkärlen. Uppbyggnaden av lipiderna i artärerna leder till åderförkalkning. Blockering av blodtillförseln, som tillhandahåller livsviktigt syre till kroppens olika delar, av en aterosklerotiskt plack eller en blodpropp leder till allvarliga konsekvenser såsom hjärtattack eller stroke. HDL (Hög-densitetslipoprotein), det ”goda kolesterolet”, är det lipoprotein i våra kroppar som är specialiserat på att avlägsna överflödigt, och därmed skaldligt kolesterol från celler och transporterar det till levern där det kan elimineras. LDL (Låg-densitetslipoprotein), å andra sidan, är det lipoprotein som ger ytterligare kolesterol till cellerna, vilket orsakar dess ansamling. Människor som har höga nivåer av LDL-kolesterol har en förhöjd risk att utveckla hjärt-kärlsjukdomar, medan de med höga HDL-nivåer är skyddade från dessa sjukdomar.
Förhindrar åderförkalkning
Nu när skillnaden mellan det "dåliga" och det "goda" kolesterolet är tydligare, skulle jag vilja rikta fokus på ApoA-I, huvudproteinet i HDL. ApoA-I har en mycket viktig funktion i avlägsnandet av kolesterolet från kärlväggens celler, vilket förhindrar utvecklingen av åderförkalkning. ApoA-I proteinet interagerar med speciella receptorer på ytan cellerna som innehåller höga nivåer av kolesterol och överför det till det växande HDL-lipoproteinet. En annan fördelaktig funktion hos ApoA-I involverar regleringen av blodsockernivåer; detta beskrivs i två av de vetenskapliga artiklar (paper I och paper II) som ingår i denna avhandling.
Insulin är ett hormon som produceras av specialiserade celler, så kallade betaceller, som finns i Langerhanska öar i bukspottkörteln. Det utsöndras efter måltider när glukosnivån i blodet är hög. Glukos är den viktigaste energikällan för celler och korrekt reglering av dess nivåer är mycket viktigt. Insulin interagerar med celler i människokroppen för att låta dem veta att de kan ta upp blodglukos och använda det som energi. Hos personer med diabetes svarar dessa celler dock inte på signalen som ges av insulin och därför förblir blodsockernivåerna höga. Detta kallas insulinresistens och till utvecklingen av diabetes-sjukdomen. För att kompensera för den höga glukosnivån producerar beta-cellerna ännu mer insulin, vilket leder till utmattning av cellerna och dysfunktion. Diabetes kan därför beskrivas som en kombination av insulinresistens och beta-celldysfunktion, och därpå följande höga blodsockernivåer. Långvarig och obehandlad diabetes leder till många komplikationer, bland vilka hjärt- kärlsjukdomar är de vanligaste.
I paper I fann vi att ApoA-I kan förbättra betacellfunktionens förmåga att utsöndra mer insulin som svar på hög glukosnivå. I våra studier så använde vi betaceller som odlades i labbet och Langerhanska öar som isolerades från möss för att förstå hur detta händer. Vi använde mikroskopi för att se ApoA-I-interaktion med betacellerna. Vi fann att ApoA-I tas upp av betacellerna och att detta leder till att mer insulinet, som förvaras i cellerna i så kallade granuler, mobiliseras och förs närmare cellens yttre skal. Detta gör att insulinet kan utsöndras snabbt och effektivt till cellens omgivning och till blodomloppet så snart behov finns dvs i samband med en måltid. Detta tillsammans med våra tidigare studier på ApoA-I proteins funktion i kroppens kontroll av glukosnivåer, vilka visade att ApoA-I ökar musklers upptag av glukos, föreslår att ApoA- I proteins mekanismer kan användas för att utveckla framtida läkemedel för att behandla diabetes och hjärt-kärlsjukdomar.
Ett av de vanligaste sätten att diagnostisera diabetes är mätningen av så kallat glykerat hemoglobin, eller HbA1c. Höga blodsockernivåer, eller hyperglykemi, under en längre tid kan leda till glykeringsmodifiering av många proteiner inklusive hemoglobin i röda blodkroppar. Hemoglobin är ett anmärkningsvärt stabilt protein som stannar länge i blodomloppet innan det bryts ner. Detta gör att nivåerna av glykerat hemoglobin kan användas för att uppskatta hur allvarlig hyperglykemin har varit under upp till de senaste 12 veckorna. ApoA-I, på liknande sätt som hemoglobin, glykeras i hyperglykemi och i paper II undersökte vi konsekvenserna av denna förändring av ApoA-I proteinet. Vi skapade ett glykerat ApoA-I och undersökte dess funktionalitet. Vi fann att det glykerade ApoA-I inte binder till lipider lika effektivt som det icke-modifierade proteinet. Dessutom var dess funktion i att avlägsna kolesterol från celler och att sänka glukosnivån hos möss inte lika effektiv jämfört med icke-glykerad ApoA-I. Vi drog slutsatsen att reglering av blodglukos är mycket viktigt för att säkerställa fullt funktionell ApoA-I.
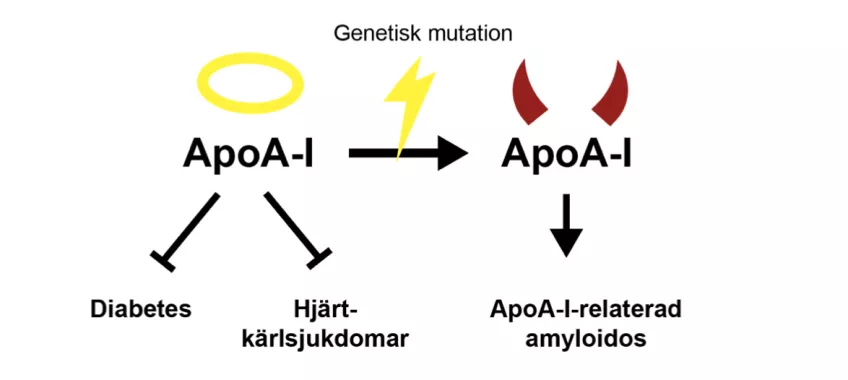
Den andra delen av denna avhandling (paper III och IV) är inriktad på en annan aspekt av ApoA-I proteinet. Vissa människor föds med en genetisk mutation som finns i genen som kodar för ApoA-I. Dessa genetiska mutationer leder till förändrade egenskaper hos ApoA-I proteinet. En viktig förändring är att de muterade ApoA-I proteinerna kan associeras med varandra och bilda amyloider, som är dysfunktionella proteinaggregat som kan ackumuleras i olika organ där de gör skada. Detta tillstånd kallas ApoA-I- relaterad amyloidos. Amyloidoser är en grupp sjukdomar som orsakas av en uppbyggnad av proteinamyloider i olika organ. Troligtvis har du hört talas om Alzheimers eller Parkinsons sjukdomar, amyloidoser som orsakar proteinamyloidansamling i hjärnan. I fallet med ApoA-I-relaterad amyloidos ackumuleras de muterade ApoA-I proteinerna i olika organ; vilket organ som påverkas beror på var mutationen sitter i APOA1-genen. Bland de mest drabbade organen är njurar, lever, struphuvud och hjärta. Eftersom denna sjukdom är mycket sällsynt och visar symptom sent i livet är det mycket svårt att diagnostisera. I dag är den enda tillgängliga behandlingen organtransplantation.
Människor med denna sjukdom har mycket lägre mängder HDL i blodet, men förvånansvärt så har de inte förhöjd risk att utveckla hjärt-kärlsjukdomar. I paper IV tillverkade och testade vi fyra av de muterade ApoA-I och vi fann att de mer effektivt tar kolesterol från celler jämfört med normalt ApoA-I. Detta kan förklara varför personer med muterad ApoA-I, trots de lägre nivåerna av HDL, inte har högre risk att utveckla hjärt-kärlsjukdomar. I paper III använde vi plasma från personer som drabbades av ApoA-I-relaterad amyloidos i våra experiment. Vi testade funktionen hos HDL från deras plasma och vi kom till samma slutsats som tidigare. Deras HDL var mer effektivt på att ta bort kolesterol från celler jämfört med personer som inte har muterat ApoA-I. Vi ville därför förstå vad som händer med proteinet när det har en mutation. Vi producerade muterat ApoA-I och utförde en speciell analys som gjorde det möjligt för oss att se om och i så fall hur proteinets struktur förändras. Vi drog slutsatsen att mutationen gör proteinet mer flexibelt. Det betyder att proteinet kan anpassas bättre för att binda mer kolesterol från celler.
Kanske kan vi göra normalt ApoA-I mer flexibelt och därför effektivare när det gäller att ta hand om det skadliga cellkolesterolet? Förhoppningsvis kan vi utvärdera detta i framtida experiment.
Fotnot: Oktawia Nilsson disputerade den 27 mars 2020